Schizophrénie : la piste d’un parasite transmis par les chats
Modifié le 8 avril 2024
Temps de lecture : 5 minutes
•julienvenesson.fr ce n’est pas que des formations professionnelles en nutrition, la sélection des meilleurs livres et des consultations avec des nutritionnistes, c’est aussi les réponses à vos questions dans les articles du blog. Bonne lecture !•
La schizophrénie est une affection mentale complexe, provoquée par un ensemble de facteurs génétiques et environnementaux. Parmi ces derniers, l’un d’eux est particulièrement intrigant. Un ensemble de découvertes menées au cours des dernières décennies pointent du doigt la part de responsabilité potentielle d’un minuscule être vivant, le parasite Toxoplasma gondii, transmis par les chats.
La toxoplasmose, une infection courante et souvent bénigne
La plupart d’entre nous découvrent l’existence de la toxoplasmose en lien avec la maternité. En effet, cette infection provoquée par le parasite Toxoplasma gondii représente un danger chez la femme enceinte, menaçant le fœtus qu’elle porte si l’infection se produit en cours de grossesse.
Dans le reste de la population, en dehors des cas d’immunosuppression, le fait d’être porteur du parasite est généralement considéré comme anodin. Cette situation concerne environ une personne sur deux dans notre pays.
Un parasite efficace
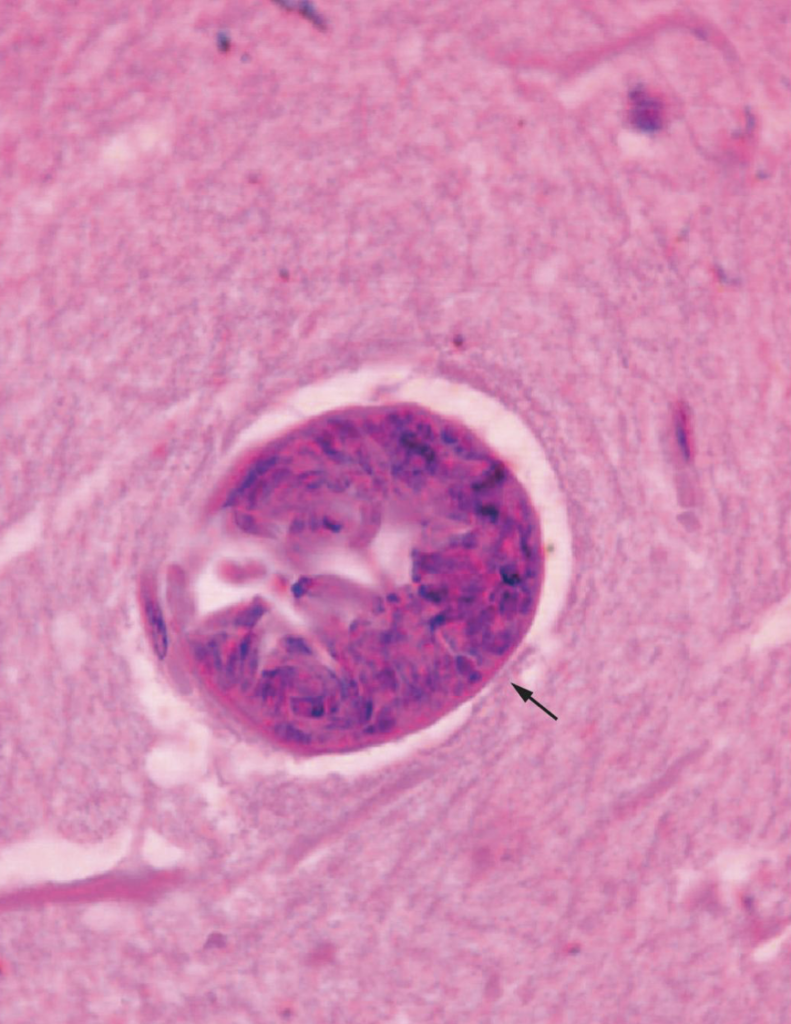
Ce taux d’infection très élevé par le toxoplasme révèle son incroyable capacité à se transmettre aux hôtes qu’il infecte. Ce protozoaire – une forme de vie minimaliste composée d’une seule cellule – est un parasite obligatoire. Il doit nécessairement infecter des animaux pour se multiplier, et agit en deux temps. Son hôte principal, ou définitif, est un félin, le chat domestique par exemple. Le parasite se reproduit dans l’intestin grêle, donnant naissance à des sphères microscopiques, les oocystes, rejetés dans l’environnement avec les selles.
L’homme, un hôte intermédiaire
Après une phase de quelques jours dans le milieu extérieur, les oocystes ont évolué et sont devenus contaminants : en cas d’ingestion, le parasite peut infecter un hôte qualifié d’intermédiaire comme le porc, le mouton, la vache… ou l’être humain. Une fois dans l’organisme, le toxoplasme se multiplie et s’enkyste dans les tissus cérébraux ou musculaires, où il persiste à l’état dormant.
Modes de contamination
Nous pouvons être contaminés par le toxoplasme de différentes façons. L’ingestion d’oocystes peut se produire lors de la consommation d’aliments – salades et autres crudités principalement – souillés par des selles contaminées de chats, ou lors de la manipulation de leur litière. Manger une viande contenant des kystes du parasite insuffisamment cuite expose également à ce risque.
Liens entre toxoplasme et schizophrénie
L’infection latente par le toxoplasme passe en général inaperçue. Des découvertes suggèrent pourtant qu’elle serait susceptible d’avoir des conséquences inattendues sur notre équilibre psychique. Des équipes de recherche se sont notamment intéressées à ses liens possibles avec une maladie mentale, la schizophrénie.
Posséder un chat, facteur de vulnérabilité
Dès 1995, des chercheurs ont émis une hypothèse surprenante : les chats domestiques pourraient transmettre un agent pathogène favorisant la survenue de la schizophrénie. De nombreuses équipes ont exploré cette question par la suite, cherchant à déterminer si le fait de cohabiter avec un chat représentait un facteur de risque pour cette maladie. Une synthèse de 17 de ces travaux a récemment été publiée. Ses auteurs sont arrivés à la conclusion suivante :
« Après ajustement des covariables, nous avons constaté que les individus exposés aux chats avaient environ deux fois plus de risque de développer la schizophrénie»
John J McGrath et al.
Infection par le toxoplasme et schizophrénie
L’ensemble des personnes ayant vécu à un moment ou l’autre de leur vie au contact des chats n’est bien sûr pas forcément porteur du toxoplasme. Des études épidémiologiques ont ainsi examiné de façon plus directe le lien entre cette infection et la schizophrénie.
Une méta-analyse de 38 projets de recherche a montré que la présence d’anticorps dirigés contre le parasite, signe d’une contamination passée, est associée à un risque d’être atteint de cette maladie multiplié par 2,73. Ce surrisque est par exemple similaire à celui lié à l’usage de cannabis.
Temporalité révélatrice
Ces données ne suffisent pas à affirmer la part de responsabilité du toxoplasme dans le déclenchement de la maladie, car elles ne permettent pas d’établir un lien de cause à effet. Cependant, d’autres éléments tendent à l’indiquer. Une étude a été menée auprès d’un groupe de 180 anciens militaires atteints de schizophrénie. Son intérêt majeur réside dans le fait que des échantillons de sang prélevés avant le diagnostic de la maladie et après celui-ci étaient disponibles. Des comparaisons du statut relatif au toxoplasme ont pu être réalisées et la séquence des événements retracée. Les résultats ont montré que le risque d’être diagnostiqué était particulièrement élevé dans les 6 mois suivant la contamination par le toxoplasme.
La schizophrénie n’est pas le seul trouble psychique pour lequel un lien a été établi avec l’infection par le toxoplasme. La présence du parasite a été associée aux troubles bipolaires, obsessionnels et compulsifs ou encore aux addictions. Les personnes infectées ont par ailleurs un risque accru de décès de causes non naturelles, de 69% pour les accidents de la route et de 39% par suicide.
Action du parasite sur le cerveau
Comment ce parasite pourrait-il troubler l’esprit au point de modifier les comportements voire de favoriser la survenue de troubles psychiatriques ? Le phénomène est loin d’avoir livré tout ses secrets, mais nous disposons d’informations sur la nature des perturbations occasionnées par sa présence dans le cerveau.
Destruction localisée de neurones
La présence des kystes renfermant le parasite dans le cerveau provoque des phénomènes localisés de nécrose. L’inflammation qui en résulte peut à son tour endommager les neurones voisins, conduisant à perte du parenchyme cérébral, le tissu fonctionnel de l’organe.
Une réduction du volume de la matière grise a d’ailleurs été observée chez des patients schizophrènes infectés par le toxoplasme, par rapport aux malades non porteurs du parasite.
Chez des souris infectées depuis 8 mois, une dissymétrie du parenchyme a été observée, ainsi qu’un agrandissement des ventricules, les cavités qui contiennent le liquide céphalorachidien.
Perturbation des neurotransmetteurs
En cas d’infection par le toxoplasme, les cellules immunitaires entrent en action pour maintenir le parasite en état de dormance et éviter qu’il ne se multiplie de manière incontrôlée. Pour y parvenir, elles sécrètent un ensemble de composés – cytokines pro-inflammatoires, interféron-γ, enzymes – qui peut perturber les neurotransmetteurs. Ces messagers chimiques permettent aux cellules cérébrales de communiquer entre elles.
Surplus de dopamine
Le parasite peut lui-même jouer un rôle direct dans ce cadre. Il dispose en effet d’une enzyme, la tyrosine hydroxylase, qui est le facteur limitant pour la fabrication de l’un des neurotransmetteurs, la dopamine. Il favorise de plus la sécrétion de dopamine par les neurones.
Cet excès de dopamine a des effets sur l’état psychologique et le comportement, et pourrait être à l’origine, au moins en partie, des changements observés chez les individus contaminés par le parasite.
Chez les rongeurs, le surplus de dopamine génère de l’hyperactivité. Chez l’être humain, des études ont pu établir un effet inverse entre la dopamine et la recherche de nouveautés par exemple. Les niveaux de dopamine sont plus élevés en cas de schizophrénie.
Surcroît de stimulation neuronale
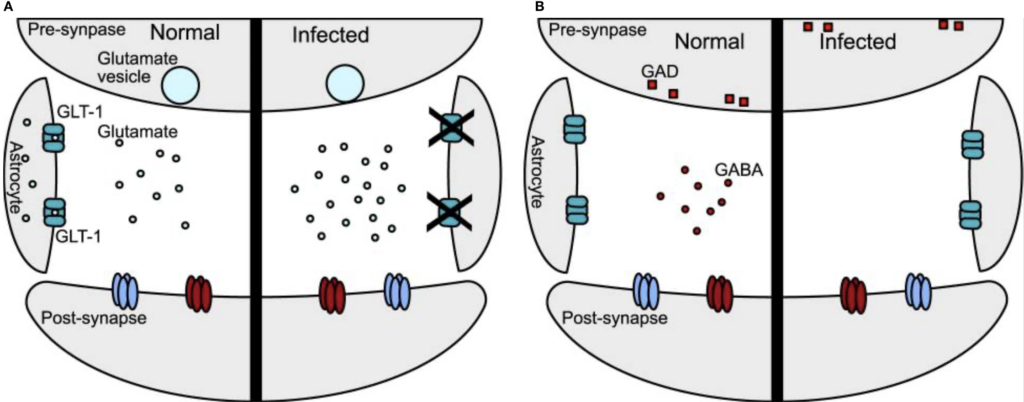
D’autres messagers chimiques du cerveau sont perturbés en cas d’infection par le toxoplasme. Des travaux menés chez la souris ont mis en évidence une augmentation des niveaux de glutamate, le principal neurotransmetteur excitateur du cerveau. En cause, un problème dans sa recapture par les cellules soutenant l’activité des neurones, les astrocytes.
Des altérations sont également visibles au niveau du principal neurotransmetteur inhibiteur du cerveau, l’acide gamma-aminobutyrique (GABA). Dans l’hippocampe, l’enzyme glutamate décarboxylase, qui convertit le glutamate en GABA, est mal localisée dans les neurones en cas d’infection par le toxoplasme. Cela provoque une baisse de la quantité de son relargage, maintenant une surstimulation des neurones situés en aval.
La capacité des parasites à manipuler le cerveau de leurs hôtes peut sembler tout droit sortie d’un scénario de science-fiction. Pourtant, ce phénomène est bien réel et largement répandu dans la nature. De nombreux parasites ont évolué pour exploiter cette stratégie afin d’assurer leur survie et leur reproduction, parfois au détriment des organismes qu’ils infectent, y compris le nôtre.
Autres articles