Les BCAA augmentent-ils le risque de cancer ?
Modifié le 10 janvier 2024
Temps de lecture : 7 minutes
•julienvenesson.fr ce n’est pas que des formations professionnelles en nutrition, la sélection des meilleurs livres et des consultations avec des nutritionnistes, c’est aussi les réponses à vos questions dans les articles du blog. Bonne lecture !•
La prise de compléments alimentaires à base de BCAA est une approche prisée par les sportifs pour améliorer leurs performances et réduire les courbatures. Des données suscitent toutefois l’inquiétude : ces composés étant utilisés par les cellules cancéreuses pour se développer, pourraient-ils favoriser la survenue de cette maladie ? Voici des éléments de réponse.
Un métabolisme chamboulé en cas de cancer
Les cellules cancéreuses se développent rapidement et présentent des besoins métaboliques accrus par rapport aux cellules saines. Elles puisent différents nutriments dans leur environnement pour les satisfaire.
Parmi les ressources utilisées, les acides aminés branchés (BCAA) figurent en bonne position. Il s’agit de la valine, leucine et isoleucine, des acides aminés essentiels que notre organisme n’est pas en mesure de synthétiser de façon autonome.
Synthèse protéique et production d’énergie
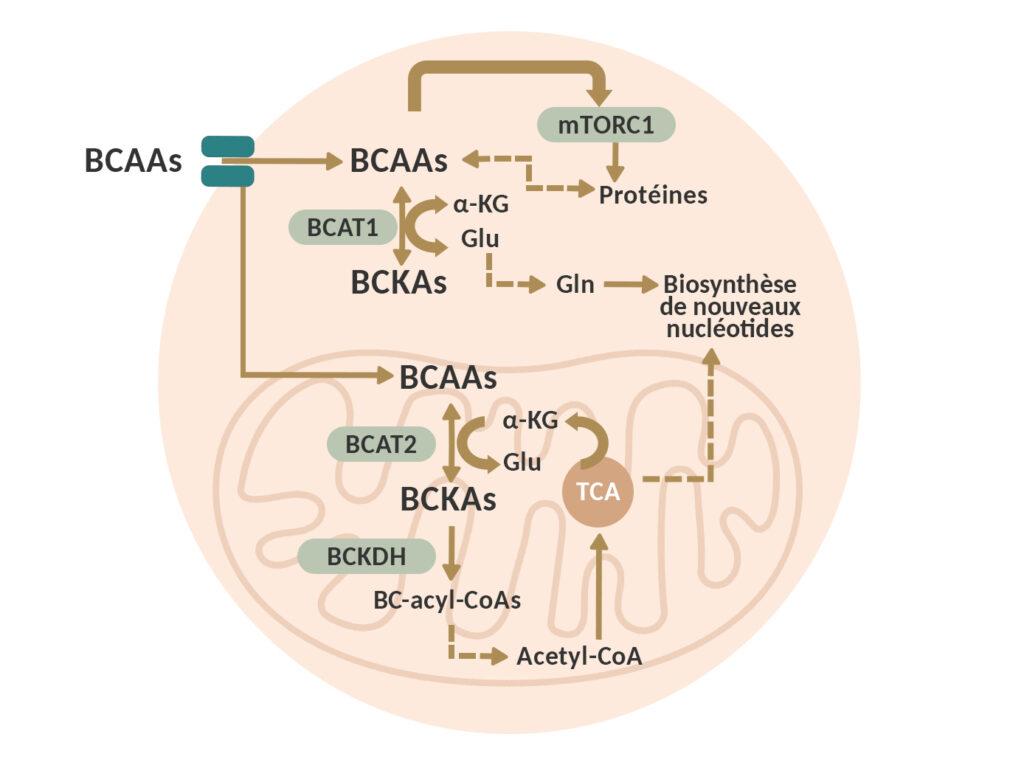
Au sein des cellules cancéreuses, les BCAA constituent des blocs élémentaires indispensables à la production de nouvelles protéines. Ils activent de plus la voie de signalisation mTORC1, qui déclenche leur fabrication. Ils fournissent également l’azote destiné à la formation des acides nucléiques (ADN, ARN).
Les BCAA sont par ailleurs dégradés au sein des mitochondries en composés à haut potentiel énergétique comme l’acétyl-CoA, qui participe à la formation de l’ATP. Ils fournissent de cette manière de l’énergie aux cellules cancéreuses pour soutenir leurs intenses activités.
Surproduction des transporteurs et enzymes
Si le rôle des BCAA n’est pas fondamentalement différent au sein d’une cellule saine ou d’une cellule cancéreuse, il existe une différence de taille entre ces deux situations. En cas de cancer, on observe une reprogrammation du métabolisme des BCAA, qui soutient la progression de la maladie.
Tout d’abord, les cellules cancéreuses peuvent produire les transporteurs qui permettent d’acheminer les BCAA depuis l’environnement en quantité accrue, comme on l’observe en cas de carcinome pancréatique canalaire, une forme de cancer du pancréas.
La plupart d’entre elles surexpriment par ailleurs les enzymes impliquées dans la première étape de l’utilisation des BCAA, les transaminases des acides aminés à chaîne ramifiée (BCAT). Il en existe deux types : la BCAT1, localisée dans le cytoplasme, et la BCAT2, présente dans les mitochondries.
Activation de la prolifération
Une étude menée sur des cellules de glioblastome, le cancer cérébral le plus commun chez l’adulte, a par exemple mis en lumière ce surcroît d’activité enzymatique. Les analyses conduites in vitro ont révélé une quantité plus élevée qu’à la normale de la BCAT1.
Sa neutralisation a permis de réduire la prolifération des cellules cancéreuses et d’altérer leur capacité d’invasion, soulignant le rôle fondamental du dérèglement de cette enzyme dans le processus de transformation maligne. Chez des animaux porteurs de ce type de tumeur, l’inhibition de la BCAT1 a freiné le développement du cancer.
Cette surexpression de BCAT1 concerne de nombreuses formes de la maladie comme la leucémie, le cancer de l’ovaire, le cancer du foie ou le cancer du sein. Pour ce dernier, ces niveaux élevés de l’enzyme sont associés à une résistance thérapeutique au tamoxifène, un médicament anti-hormonal souvent prescrit dans ce contexte, et à une survie réduite des patientes.
Apports alimentaires et risque de cancer
Au vu des liens étroits entre cancer et métabolisme des BCAA, de nombreuses études ont été menées auprès d’échantillons de population pour tenter de déterminer si les apports alimentaires en ces composés pouvaient avoir un impact sur le risque de cancer. Les résultats obtenus sont très différents selon les formes de la maladie.
Absence de lien avec le cancer du sein
Une étude de grande ampleur a analysé les données recueillies auprès de 196 161 femmes américaines des cohortes Nurses’ Health Study et Nurses’ Health Study II suivies pendant une vingtaine d’années.
Elle n’a pas retrouvé de lien quelconque entre les apports alimentaires en BCAA totaux ou pour chacun d’entre eux considérés individuellement et la survenue du cancer du sein.
Optimisation de l’immunité antitumorale
Les résultats de travaux conduits chez la souris suggèrent d’éventuels bénéfices d’un régime riche en BCCA une fois la maladie déclarée.
Les animaux bénéficiant d’apports alimentaires renforcés en ces acides aminés présentent une croissance tumorale ralentie, avec une formation limitée de métastases au niveau des poumons.
Pourtant, ni la prolifération des cellules cancéreuses n’a été modifiée, ni même la vascularisation des tumeurs.
En revanche, l’augmentation des niveaux de BCCA conduit à une multiplication d’un type particulier de défenses cellulaires au niveau de la rate, les NK (Natural Killer), capables de détruire les cellules cancéreuses.
Ils réduisent en parallèle la formation de la N-cadhérine, une protéine qui facilite la mobilité et l’invasion des cellules tumorales dans les autres tissus.
Augmentation du risque de cancer du pancréas
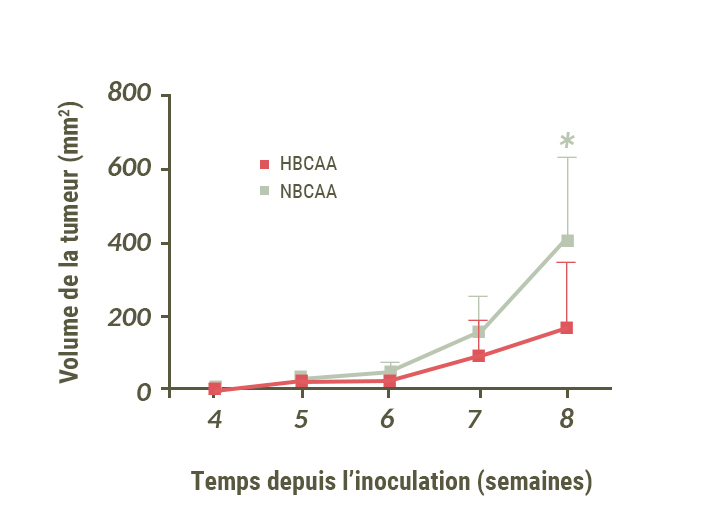
Une étude menée en Italie auprès de 326 personnes atteintes d’un cancer du pancréas et 652 participants en bonne santé a en revanche établi un lien le niveau d’apports alimentaires en BCAA et le risque de développer cette maladie.
Les participants consommant les plus fortes quantités présentaient un risque de développer la maladie multiplié par deux. Des expériences conduites chez la souris ont confirmé l’influence négative d’une alimentation riche en BCAA, qui accélère la progression de l’adénocarcinome canalaire du pancréas.
Diminution du risque de cancer du côlon
La même équipe de chercheurs italiens s’était auparavant intéressée aux habitudes alimentaires de 1953 personnes souffrant d’un cancer colorectal et de 4154 sujets sains.
Les résultats avaient été dans ce cas à l’opposée des résultats précédents : les apports élevés en BCAA se sont avérés légèrement bénéfiques contre cette maladie, avec une baisse de 10% du risque de la développer.
La protection a été plus marquée pour une de ses formes particulières affectant la partie terminale du tube digestif, le cancer du côlon sigmoïde, atteignant 51%.
Protection multifacettes
Plusieurs pistes pourraient expliquer cet effet protecteur. L’obésité et les troubles du métabolisme qui lui sont associés (résistance à l’insuline, diabète de type2) représentent un facteur de risque clairement identifié de cancer colorectal.
Une étude chez des souris obèses a montré que la supplémentation en BCAA bloque le développement de lésions précancéreuses au niveau du côlon, possiblement en atténuant la résistance à l’insuline.
Par ailleurs, l’isoleucine atténue la production du facteur de croissance endothélial vasculaire et pourrait de cette manière contrer l’angiogenèse nécessaire pour alimenter les tumeurs.
Enfin, les BCAA stimulent la synthèse de la glutamine, un composé qui protège la paroi intestinale de l’inflammation et du stress oxydatif.
Un taux sanguin élevé est-il un facteur de risque de cancer ?
D’autres travaux ont exploré le lien entre le taux sanguin de BCAA et le risque de survenue d’un cancer. Une étude a par exemple mis en évidence une multiplication du risque de cancer du pancréas par près de 2,5 chez les personnes présentant les niveaux les plus élevés, par rapport à ceux présentant les plus faibles.
Une équipe a mené une étude basée sur une approche statistique, la randomisation mendélienne, pour établir un éventuel lien de causalité entre le taux sanguin de BCAA et neuf cancers différents.
La seule association positive a été obtenue pour le cancer du poumon à cellules squameuses, qui représente environ le quart des cancers du poumon.
Le témoin d’une alimentation déséquilibrée

Le taux sanguin en BCAA n’est toutefois pas le reflet parfait des apports alimentaires en ces composés.
Ils sont principalement présents dans la viande, le poisson, les légumineuses, les produits laitiers et les œufs et représentent 15 à 25% de l’apport total en protéine alimentaire.
Des chercheurs ont en effet montré qu’une concentration sanguine élevée en BCAA est plutôt le signe d’une alimentation déséquilibrée, trop riche en aliments animaux, pauvre en protéines végétales et en fibres, avec une composition défavorable en acides gras.
Ce profil alimentaire est propice à l’installation de nombreuses pathologies chroniques, dont le cancer.
Les effets de la supplémentation
Certains essais cliniques sont menés pour explorer les effets potentiels de la supplémentation en acides aminés, y compris les acides aminés à chaîne ramifiée (BCAA), dans le domaine de la cancérologie.
Bienfaits en cas de cancer du foie
La plupart des études menées chez l’Homme concernent le cancer du foie. L’une d’elles a été conduite chez des patients devant subir une opération chirurgicale visant à retirer un carcinome hépatocellulaire, à l’aide d’une procédure d’ablation par radiofréquence.
Une partie des volontaires recrutés a bénéficié d’une supplémentation en BCAA initiée deux semaines avant l’intervention. Le groupe a ensuite été suivi pendant près de 4 ans.
La supplémentation a amélioré la survie sans événement, qui correspond à la durée pendant laquelle aucun événement indésirable lié à la maladie ne survient, et a réduit le taux de rechute par rapport au placebo.
Une méta-analyse ayant porté sur 16 études et près de 1600 patients a conclu que la supplémentation en BCAA améliore le taux sanguin d’albumine. Cet indicateur est souvent utilisé en cas de cancer du foie, car il reflète le bon fonctionnement de cet organe.
Alléger les suites opératoires
Une autre méta-analyse a compilé les résultats de 13 essais cliniques et 6 études observationnelles consacrées aux effets de la supplémentation chez les patients atteints de cancer et traités par chirurgie.
Elle révèle une réduction du risque d’infection postopératoire de 38% grâce aux BCAA. De plus, la prise de ces acides aminés est bénéfique contre l’ascite, une accumulation anormale de liquide dans la cavité abdominale, pour le maintien du poids corporel et une limitation de la durée d’hospitalisation.
Un soutien possible contre la cachexie
La cachexie, qui correspond à une perte de poids involontaire et une fonte musculaire, est fréquente chez les personnes atteintes d’un cancer. La supplémentation en acides aminés est une piste envisagée pour enrayer ce phénomène. Dans ce cadre, la leucine a notamment fait l’objet d’études précliniques, qui indiquent qu’elle peut l’endiguer efficacement.
Il existe peu de données chez l’être humain. Une étude a été menée chez des patients atteints d’un cancer à un stade avancé. Pendant 12 semaines, 27 d’entre eux ont bénéficié d’une intervention basée sur un programme d’exercice physique et de nutrition, couplé à une supplémentation en leucine, tandis que 25 ont constitué un groupe contrôle.
À l’issue de cette période, la force de préhension s’est améliorée dans le groupe ayant reçu le traitement, suggérant une amélioration des capacités physiques.
Cependant, des inquiétudes persistent sur le possible effet dopant de l’approche sur le développement tumoral. Une étude très récente menée chez des souris atteintes de cachexie liée à un cancer colorectal a montré que la supplémentation en leucine a réduit le taux de survie des mâles, sans apporter le moindre effet positif sur la reconstruction du tissu musculaire.
Autres articles



